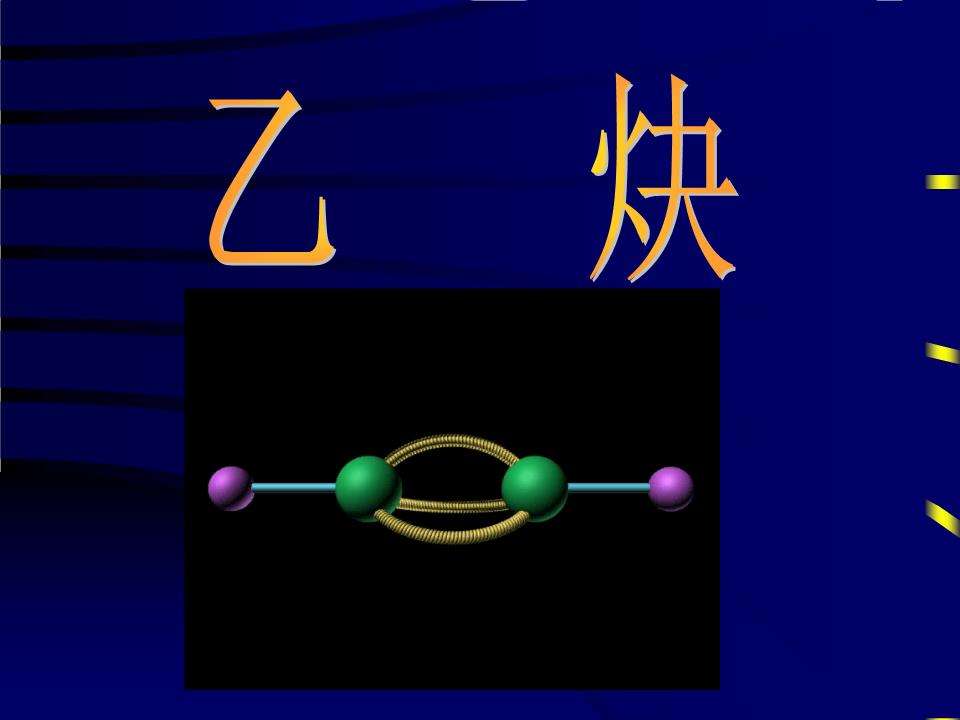
化学名称乙炔
用途实验室
储存方法钢瓶
包装规格40L
产品名称高纯乙炔
别名电石气
作用乙炔可用以照明、焊接及切断金属(氧炔焰),也是制造乙醛、醋酸、苯、合成橡胶、合成纤维等的基本原料。
使用范围工业
纯度99.6
状态气体
我公司主要经营:氧气,乙炔气,氮气,氩气,液氧、液氩、液氮、液化石油气、氨气,...天津市利信工业气体经销部,成立多年来一直秉承“您的需要就是我们的使命”的原则
氧化反应
a.可燃性:
2C₂H₂+5O₂→4CO₂+2H₂O(条件:点燃)
现象:火焰明亮、带浓烟,燃烧时火焰温度很高(>3000℃),用于气焊和气割。其火焰称为氧炔焰。
b.被KMnO4氧化:能使紫色酸性溶液褪色。
C₂H₂ + 2KMnO₄ + 3H₂SO₄=2CO₂+ K₂SO₄ + 2MnSO₄+4H₂O

乙炔(acetylene)简单的炔烃,又称电石气。结构式H-C≡C-H,结构简式CH≡CH,简式(又称实验式)CH,分子式 C2H2,乙炔中心C原子采用sp杂化。电子式 H:C┇┇C:H乙炔分子量 26.4 ,气体比重 0.91(Kg/m3),火焰温度3150 ℃,热值12800 (千卡/m3) 在氧气中燃烧速度 7.5 ,纯乙炔在空气中燃烧2100度左右,在氧气中燃烧可达3600度。化学性质很活泼,能起加成、氧化、聚合及金属取代等反应。

乙炔在高温解为碳和氢,由此可制备乙炔炭黑。一定条件下乙炔聚合生成苯,,二,,萘,蒽,苯乙烯,茚等芳烃。通过取代反应和加成反应,可生成一系列较有的产品。例如乙炔二聚生成乙烯基乙炔,进而与进行加成反应得到氯丁二烯;乙炔直接水合制取乙醛;乙炔与进行加成反应而制取氯乙烯;乙炔与乙酸反应制得乙酸乙烯;乙炔与氰化氢反应制取丙烯腈;乙炔与氨反应生成甲基吡啶和2-甲基-5-乙基吡啶;乙炔与反应生成二基乙烯,进一步催化剂裂化生成三种甲基苯乙烯的异构体:乙炔与一分子甲醛缩合为,与二分子甲醛缩合为丁炔二醇;乙炔与丙酮进行加成反应可制取甲基炔醇,进而反应生成异戊二烯;乙炔和一氧化碳及其他化合物(如水,醇,硫醇)等反应制取丙烯酸及其物。

金属取代反应(可用于乙炔的定性鉴定)
将乙炔通入溶有金属钠的液氨里有氢气放出。乙炔与银氨溶液反应,产生白色乙炔银沉淀。
乙炔具有弱酸性,因为乙炔分子里碳氢键是以SP-S重叠而成的。碳氢里碳原子对电子的吸引力比较大些,使得碳氢之间的电子云密度近碳的一边大得多,而使碳氢键产生极性,给出H+而表现出一定的酸性。(pKa=25)
将其通入硝酸银或氯化亚铜氨水溶液,立即生成白色乙炔银(AgC≡CAg)和棕红色乙炔亚铜(CuC≡CCu)沉淀,可用于乙炔的定性鉴定。这两种金属炔化物干燥时,受热或受到撞击容易发生爆炸,如反应完应用盐酸或硝酸处理,使之分解,以免发生危险。注意:乙炔在使用贮运中要避免与铜接触。
http://lixinqiti.b2b168.com